اسید چیست؟
اسید چیست؟ به هر ماده ای گفته می شود که چند خاصیتی که ذکر خواهد شد را داشته باشد: محلول آب را ترش مزه می کند، رنگ شاخصی ویژه مانند کاغذ تورنسل را از آبی به قرمز بر می گرداند، با در صورت واکنش با بعضی از فلزات هیدروژن آزاد می کند و در صورت واکنش با بازها نمک تشکیل می گردد و همچنین باعث تقویت برخی از واکنش های شیمیایی می شود. برخی از اسیدهای معروف به عنوان اسیدهای غیر آلی (معدنی) شامل: نیتریک اسید، هیدرو کلریک اسید، فسفریک اسید و سولفوریک اسید و برخی اسیدهای آلی شامل: فنل، کربوکسیلیک اسید و سولفونیک اسید می باشد. این دست از مواد دارای یک یا چندین اتم هیدروژن در ترکیب شیمیایی خود هستند که در محلول به شکل یون های هیدروژن با بار مثبت (H+) جدا شده و آزاد می شوند (طبق نظریه آرنیوس).
تقسیم بندی اسیدها در صورت کلی
اسیدها در صورت کلی به دو نوع اسیدهای آلی و اسیدهای غیر آلی (معدنی) تقسیم می گردند. لازم به ذکر است که اسیدهای آلی به میزان اسیدهای معدنی یا غیر آلی قدرت ندارند و قوی نیستند. تفاوت اسیدهای آلی و غیر آلی به خاطر کربن موجود در ترکیبشان می باشد. اسیدهای آلی دارای کربن در ترکیب خود می باشند.
- اسیدهای آلی
این نوع از اسیدها دارای ویژگی های خورندگی و سمی بودن هستند. این خورندگی برای بافت هایی است که اسید در تماس مستقیم با آن ها است. این اسیدها به دلیل گوناگونی و تنوع بسیار در ساختار شیمیایی خود، تقریباً در انواع تولیدات شیمیایی به کار می روند. این دست از اسیدها شامل انواع ذیل می باشند:
- فرمیک اسید
- استیک اسید
- سیتریک اسید
- اسیدهای معدنی (غیر آلی)
این نوع از اسیدها در صورت بی آب بودن به شکل گازی یا جامد می باشند. انیدرید، یک اکسید از متالوئید است که در صورت ترکیب شدن با آب اسید معدنی یا غیر آلی را به وجود می آورد.
این دست از اسیدها شامل انواع ذیل می باشند: اسید چیست؟
- فسفریک اسید (H3PO4)
- سولفوریک اسید (H2SO4)
- نیتریک اسید (HNO3)
دانستنی های بیشتر در مورد اسیدها
طبق نظریه لوری- برونستد، اسید یک یون یا یک مولکول است که می تواند یون هیدروژن با بار مثبت را اعطا کند؛ اما طبق نظریه لوئیس یک اسید، می تواند با یک جفت الکترون پیوند کووالانسی بسازد. در اسیدهای از نوع لوری- برونستد، اسیدها پروتون اهدا می کنند و این اسیدها در شرایط خاصی از محلول های آبی، یون هیدرونیوم H3O+ را تشکیل داده و به اسیدهای آرنیوس معروف هستند. لوری و برونستد با تعمیم نظریه آرنیوس، دامنه آن را به حلال های غیر آبی گسترش دادند. اسیدهای لوری- برونستد، دارای یک اتم هیدروژن متصل به ساختار خود هستند که با از دست دادن یون هیدروژن با بار مثبت، کماکان از نظر انرژی در وضعیت مطلوب هستند. کلمه اسید از لاتین acidus / acēre مشتق شده است و به معنی ترش می باشد.
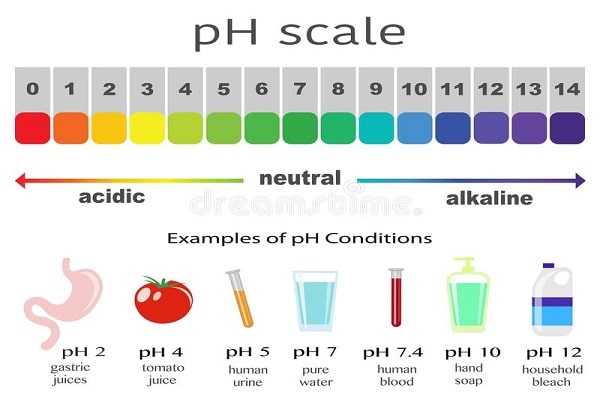
اگر اسید به صورت محلول آبی باشد، PH آن کمتر از 7 است و در زبان عامیانه به آن اسید گفته می شود. در صورتی که در تعریف دقیق آن، تنها به املاح تمرکز دارد. هر چه PH یک محلول کمتر باشد، آن محلول اسیدی تر بوده و دارای یون های هیدروژن با بار مثبت غلیظ تری می باشد. در واقع موادی که دارای خواص اسید را دارند، اسیدی می باشند. از اسیدهای آبی رایج می توان به استیک اسید (سرکه نوع رقیق آن)، کلریدریک اسید (محلول هیدروژن کلرید موجود در اسید معده جهت فعال سازی آنزیم های گوارشی)، سیتریک اسید (موجود در مرکبات) و سولفوریک اسید (مورد استفاده در باتری ماشین) اشاره نمود. اسیدهای قوی و برخی اسیدهای ضعیف که غلیظ می باشند دارای خاصیت خورندگی می باشند، ولی کربوران و اسید بوریک موارد استثنا هستند. دسته دیگر از این اسیدها، اسیدهای لوئیس می باشند که با یک جفت الکترون پیوند کووالانسی تشکیل می دهد. به عنوان نمونه اتم بور از تری فلوئورید بور (BF3)، می تواند با یک اتم در یک پایه، یک پیوند کووالانسی تشکیل دهد.
قدرت اسیدها
قدرت اسیدها بیانگر توانایی و تمایل آن ها به از دست دادن پروتون می باشد. در واقع اسید قوی، اسیدی است که به صورت کامل در آب جدا گردد؛ اما اسیدهای ضعیف، تنها تا حدی جدا می گردند. شایان ذکر است در حالت تعادل هم اسید و باز به صورت مزدوج در محلول می باشند. مثال هایی از اسیدهای قوی، کلریدریک اسید (HCl)، هیدرو یدیک اسید (HI)، هیدرو برومیک اسید (HBr)، پرکلریک اسید (HClO4)، نیتریک اسید (HNO3)، سولفوریک اسید (H2SO4) می باشند. این اسیدها در آب به صورت %100 یونیزه می شوند. در واقع هر چه یک اسید قوی تر باشد، راحت تر پروتون هیدروژن مثبت را از دست می دهد. قطبیت پیوند H- A و اندازه اتم A، دو عامل مهم و اصلی در سهولت این جداسازی می باشد. سولفونیک اسیدها (که از نوع اکسیدهای آلی می باشند)، از دسته اسیدهای قوی محسوب می شوند. به عنوان مثال می توان از اسید تولوئن سولفونیک (اسید توسیلیک) نام برد. برعکس سولفوریک اسید، سولفونیک اسیدها گاهی به شکل جامد می باشند. برای نمونه پلی استایرن، پلاستیک جامد شدیداً اسیدی است که می تواند تصفیه شود. از اسیدهای قوی تر از سولفوریک اسید می توان از سوپر اسیدها نام برد. فلورانتیمونیک اسید، ماژیک اسید و پرکلریک اسید مثال هایی از این سوپر اسیدها هستند. سوپر اسیدها دائماً با جداسازی پروتون از آب، قادر به تشکیل و تولید نمک های هیدرونیوم یونی و بلوری می باشند. آن ها قادر به تثبیت کمبودهای کربوهیدرات نیز می باشند. قدرت ترکیب های اسیدی با Ka اندازه گیری و همچنین قدرت محلول اسید آبی با Ph که نشان دهنده میزان و غلظت هیدرونیوم در محلول است، اندازه گیری می شود.

کاربرد انواع اسیدها در زندگی
اسیدها به صورت جهان شمولی در زندگی انسان ها حضور و وجود دارند.اسید چیست؟
-
کاربرد انواع اسیدها در صنعت
اسید چیست؟ تقریباً در همه فرآیندهای صنعت امروز واکنش دهنده های اصلی و اساسی هستند. سولفوریک اسید (که یک اسید دیپروتیک) که در بیشترین تولیدات مواد شیمیایی در صنعت دخیل است، پرکاربردترین اسید در صنعت به شمار می رود. بر اساس داده های موجود در سال 2011، سولفوریک اسید به مقدار 200 میلیون تن در سال بوده است. برای نمونه مواد معدنی فسفات با سولفوریک اسید جهت تولید کودهای فسفاته واکنش داده و فسفریک اسید را تولید می نماید؛ و تصفیه محلول با حل شدن اکسید روی در سولفوریک اسید انجام می گیرد. لازم به ذکر است که اسیدها وارد واکنش در ترکیبات و واکنش های خنثی سازی شده و باعث تولید نمک می شوند. به عنوان نمونه نیتریک اسید با آمونیاک وارد واکنش شده و باعث تولید آمونیوم نیترات نوعی کود می شود. همچنین کربوکسیلیک اسیدها با الکل ها واکنش داده و استرها تولید می شوند. در فرآیندی که به عنوان فرآیند ترشی شناخته می شود، غالباً از اسیدها به منظور حذف و از بین بردن زنگ زدگی و خوردگی استفاده می گردد. از اسیدها همچنین به عنوان الکترولیت در باتری سلول مرطوب مثل سولفوریک اسید در باتری اتومبیل استفاده می گردد.
-
کاربرد انواع اسیدها در مواد غذایی
تارتاریک اسید چیست؟ به عنوان یکی از مواد مهم مانند تمر هندی در غذاهای معمول استفاده می گردد. همچنین سبزیجات و میوه های طبیعی دارای اسید می باشند. سیتریک اسید در مرکبات مانند پرتقال و لیمو موجود می باشد. اسفناج، گوجه فرنگی و بخصوص ریواس و کارامبولا دارای اگزالیک اسید می باشند. اسکوربیک اسید که نوعی ویتامین c است به عنوان یکی از ضروری ترین ویتامین ها برای بدن انسان در غذاهایی مثل لیمو، مرکبات، آملا (انگور فرنگی هندی) و گواوا وجود دارد. بیشتر اسیدها به عنوان مواد نگهدارنده که باعث تغییر طعم غذا نیز می شوند، به عنوان مواد افزودنی به غذاها اضافه می گردند. به عنوان نمونه، فسفریک اسید جزء تفکیک نشدنی نوشیدنی های کولا و نوشابه ها می باشد. همچنین به طور معمول از استیک اسید به عنوان سرکه استفاده می گردد. در ترشی ها و سس ها از سیتریک اسید به عنوان ماده نگهدارنده استفاده می گردد. از اسیدها همچنین در مواد دارویی استفاده می شود. به عنوان نمونه، استیل سالیسیلیک اسید (آسپرین) به عنوان پایین آورنده تب و مسکن استفاده می گردد. کربنیک اسید از افزودنی های اسیدی است که به طور گسترده در نوشابه ها اضافه می شوند. فرآیند آن به گونه ای است که CO2، تحت فشار قرار گرفته تا در نوشیدنی ها حل شده و کربنیک اسید تولید شود. کربنیک اسید دارای ناپایداری زیادی است و تمایل دارد در دمای اتاق به آب و CO2 تجزیه گردد و لذا هنگام باز شدن درب این قوطی ها و بطری ها، گاز CO2، بیرون آمده و این نوشیدنی ها، گازدار می شوند.

-
کاربرد اسیدها در بدن انسان
اسیدها نقش بسیار مهمی در بدن ایفا می کنند. مثلاً کلریدریک اسید با تجزیه مولکول های غذایی بزرگ و حجیم در معده، به هضم غذا در بدن کمک می نمایند. اسیدهای آمینه برای رشد و ترمیم بافت های بدن جهت سنتز پروتئین های مورد نیاز، ضروری هستند. اسیدهای چرب، برای رشد و ترمیم بافت های بدن بسیار ضروری هستند. نوکلئیک اسیدها برای تولید DNA و RNA و انتقال صفات به فرزندان از طریق ژن ها مورد استفاده قرار می گیرند. کربنیک اسید برای برقراری تعادل PH در بدن کاربرد دارند. انواع ترکیبات آلی و غیر آلی، در بدن انسان موجود هستند. از جمله دی کربوکسیلیک اسیدها که نقش مهم و اساسی در بیشتر رفتارهای بیولوژیکی دارند. عمدتاً این اسیدها از نوع اسیدهای آمینه هستند که به سنتز پروتئین ها می پردازند. اسیدهای ضعیف به عنوان بافر با پایه های مزدوج خود عمل نموده تا تعادل PH بدن تعادل خود را حفظ نموده تا به سلول ها ضرری نرسد. مابقی دی کربوکسیلیک اسیدها در سنتز ترکیبات گوناگون بیولوژیکی مهم در بدن انسان مشارکت می نمایند.
تجزیه اسیدها
اسیدها کاربردی به عنوان کاتالیزور در شیمی آلی و صنعتی دارند. به عنوان نمونه، سولفوریک اسید در فرآیند آلکیلاسیون به منظور تولید بنزین بسیار کاربرد دارد. بعضی از اسیدها مثل سولفوریک اسید، فسفر و هیدروکلریک نیز واکنش های بدون آب و میعانی را ایجاد می نمایند. در بیوشیمی، بیشتر آنزیم ها از تجزیه اسید استفاده می نمایند.
اسید چیست؟ اسیدهای متداول در جهان
- اسیدهای معدنی
- هالیدهای هیدروژن و محلول های آن ها: اسید هیدروفلوئوریک (HF)، اسید کلریدریک (HCl)، اسید هیدروبرومیک (HBr)، اسید هیدرویدیک (HI)
- اکسیدهای هالوژن: اسید هیپوکلروس (HClO)، اسید کلروس (HClO2)، اسید کلریک (HClO3)، اسید پرکلریک (HClO4) و آنالوگ های مربوطه برای برم و ید
- هیپوکلروس اسید
- اسید هیپوفلوئور، تنها اکسید شناخته شده برای فلوئورین
- اسید سولفوئوریک
- اسید فلوئور سولفوریک
- اسید نیتریک
- اسید فسفریک
- اسید فلورانتیمونیک
- اسید فلوئورو بوریک
- هگزا فلوئورو فسفریک اسید
- اسید کرومیک
- اسید بوریک
- اسیدهای سولفونیک
- اسید متان سولفونیک
- اسید اتان سولفونیک
- اسید بنزن سولفونیک
- اسید پی- تولوئن سولفونیک
- اسید تری فلوئورمتان سولفونیک
- اسید پلی استایرن سولفونیک
- اسیدهای کربوکسیلیک
- اسید استیک
- اسید سیتریک
- اسید فرمیک
- اسید گلوکونیک
- اسید لاکتیک
- اسید اگزالیک
- اسید تارتاریک
- اسیدهای کربوکسیلیک هالوژنه
- اسید فلوئور استیک
- اسید تری فلوئور استیک
- اسید کلرو استیک
- اسید دی کلرو استیک
- اسید تری کلرو استیک
- اسیدهای کربوکسیلیک وینیلوس
- اسید اسکوربیک
- اسیدهای نوکلئیک
- اسید دئوکسی ریبونوکلئیک (DNA)
- اسید ریبونوکلئیک (RNA)

از کجا اسید بخریم؟
برای خرید اسید و مشاوره و راهنمایی در رابطه با اینکه اسید چیست؟ و استعلام قیمت با کارشناسان مجموعه اَوِسینا شیمی تماس حاصل فرمایید.
